作为动态生物分子,蛋白质在肿瘤产生和发展过程中会发生丰度和结构的变化。与肿瘤发生关联的蛋白质异质性为阐明癌症发病机制提供了诊断信息,因此特异性蛋白是肿瘤诊断和药物设计的重要生物标志物。小细胞外囊泡(sEV)是由细胞释放的纳米尺度(直径30–200 nm)的膜囊泡。来自源细胞的蛋白质、核酸和脂质等与肿瘤产生发展相关的生物载物可以选择性地包装到sEV中,并通过膜融合和内吞作用等生理途径传递到受体细胞,影响受体细胞的生理功能,进而促进肿瘤的发生和发展。由于肿瘤来源sEV中的蛋白质异质性与肿瘤的恶性程度相关,并反映了肿瘤进展和转移的能力,因此对sEV蛋白组分的研究,有助于阐明sEV在肿瘤转移和侵袭中的作用,并促进体液活检的发展和癌症标志物的开发。传统蛋白质组学仅限于获得肿瘤细胞衍生的sEV族群的蛋白质表达信息,其在用于研究单个sEV蛋白组分时缺乏分辨率和灵敏度,特别是对蛋白质结构信息的获取。因此单个sEV的分子分析和异质性评估在技术上仍具有挑战性。光学表征提供了无损、快速、非侵入性的便捷探测手段研究蛋白质的组分和结构信息,然而由于远场光谱学的微米级光斑与百纳米级sEV直径之间的尺寸差异,使得远场光谱技术仅限于开展对sEV族群的大样本分析,其检测灵敏度和特异性受到sEV的异质性和sEV纯化挑战的影响。
针对单个sEV蛋白组分分析的瓶颈,中国科学院物理研究所/北京凝聚态物理国家研究中心L04组陈佳宁研究员,SM4组叶方富研究员与国家纳米科学中心朱凌研究员、杨延莲研究员、王琛研究员和中国科学技术大学附属第一医院马小鹏副主任医师合作。利用自搭建纳米红外光谱系统(nano-FTIR)的10 nm尺度红外光场局域增强,在蛋白质酰胺I带(1600–1700 cm-1)和酰胺II带(1510–1580 cm-1)的指纹光谱频段内,通过对直径160–200 nm,高度为50–60 nm的单个sEV开展原位红外指纹光谱研究。结合酰胺I带吸收频率对蛋白质骨架结构的高度敏感性,通过对健康和不同恶性程度细胞来源的单个sEV的红外光谱进行统计分析发现由于蛋白质中的C-O键和氨基酸C-OH基团中的氢键随着癌症的发展遭到破化,酰胺I/II吸收比值随着sEV来源细胞系的恶性程度增加而增加;高恶性癌症细胞来源sEV中蛋白质二级结构α-螺旋+随机卷曲的含量发生显著下降,反平行β-折叠+β-转角显著增加,这种蛋白质二级结构的改变一方面与癌细胞来源sEV在癌症发展演化起到的生理功能有关,另一方面在癌变细胞中富含β-折叠+β-转角的蛋白质的生物合成消耗更多的能量,癌症中线粒体异常的有氧糖酵解表现出异常能量代谢(即Warburg效应)在癌症的发生和发展中起着至关重要的作用,而癌变细胞来源sEV中β-折叠+β-转角含量增加带来的更多能量消耗是Warburg效应的一种表现。作为临床应用的探索,进一步分析了从两名乳腺癌患者的原发肿瘤组织中提取的sEV(I期,无转移;IIB期,有淋巴结转移)。相较于无转移患者来源的sEV,淋巴结转移患者的α-螺旋+随机卷曲比例显著降低,分子间反平行β-折叠+β-转角比例显著提高,病人组织来源sEV蛋白质二级结构占比的变化与细胞来源的sEV中的结论一致。研究结果显示了nano-FTIR在单个sEV分子鉴定的优势,证明了sEV蛋白异质性在癌症检测和肿瘤恶性评估中的意义和临床价值,为基于sEV的nano-FTIR分子指纹谱识别的癌症诊断提供了体液活检解决方案。
国科温州研究院博士后薛孟飞(中国科学院物理研究所毕业)和清华大学博士叶思源(国家纳米科学中心联合培养)为共同一作。陈佳宁研究员和国家纳米科学中心的朱凌研究员、杨延莲研究员为共同通讯作者。
相关工作近期以“Single-vesicle Infrared Nanoscopy for Noninvasive Tumor Malignancy Diagnosis”发表在《JACS》杂志上,上述研究工作得到了科技部重点研发计划、国家自然科学基金、中国科学院战略性先导科技专项、中国博士后科学基金和中国科学院青年创新促进会的支持。
原文链接:https://doi.org/10.1021/jacs.2c07393
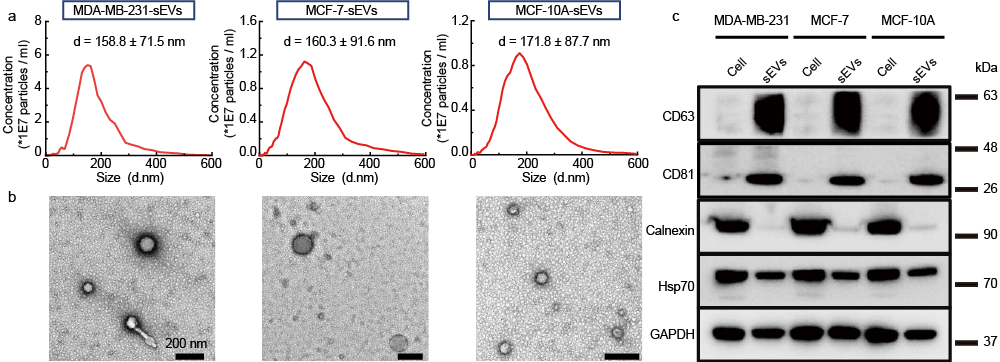
图 1 细胞外分泌囊泡的提取和纯化。
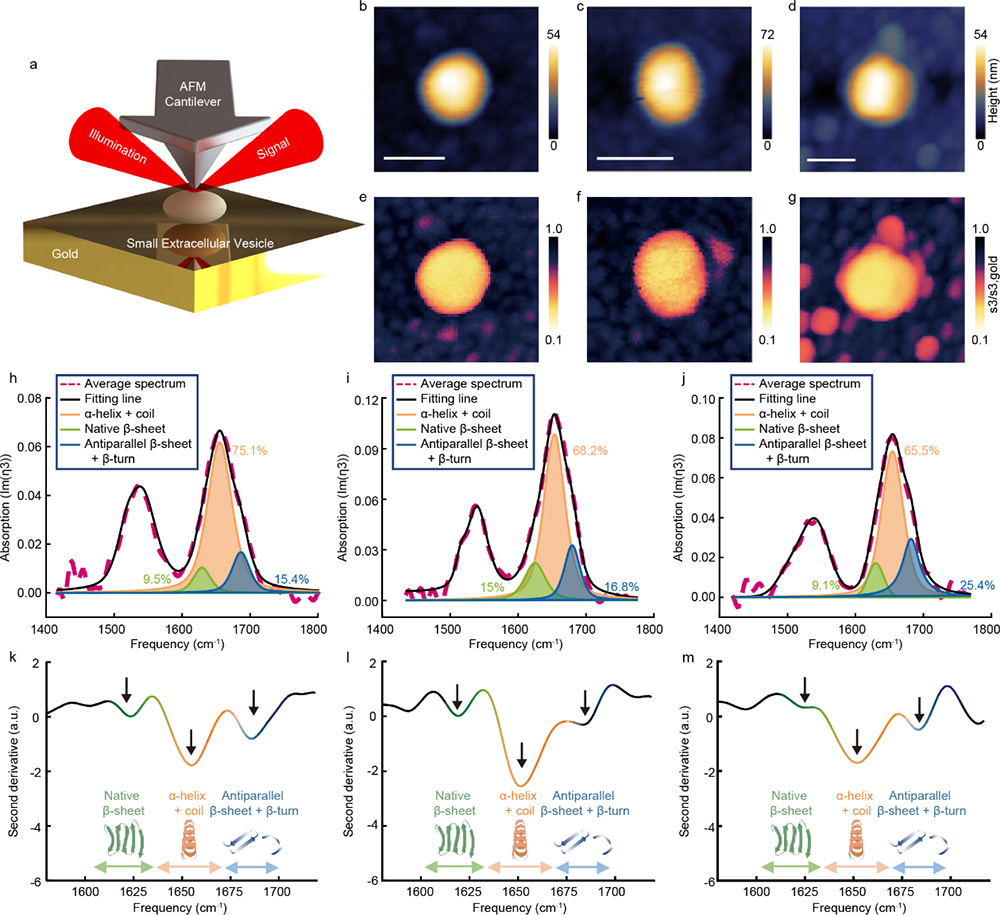
图 2 单个细胞外分泌囊泡的近场红外成像和原位红外吸收光谱。
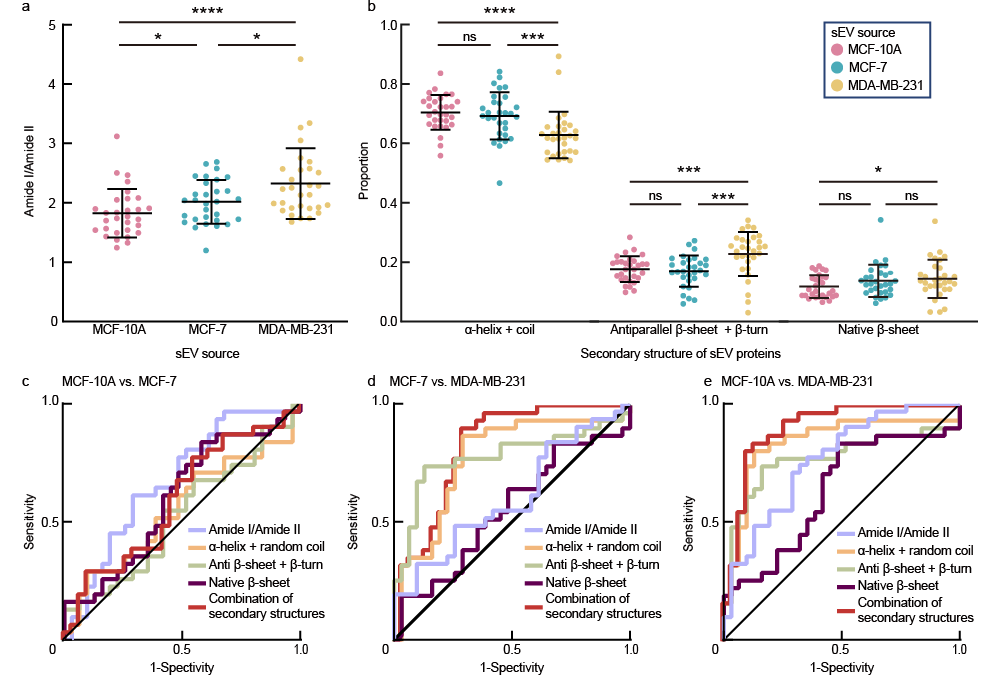
图 3 单个细胞外分泌囊泡的蛋白指纹光谱作为癌症恶性程度的指标。
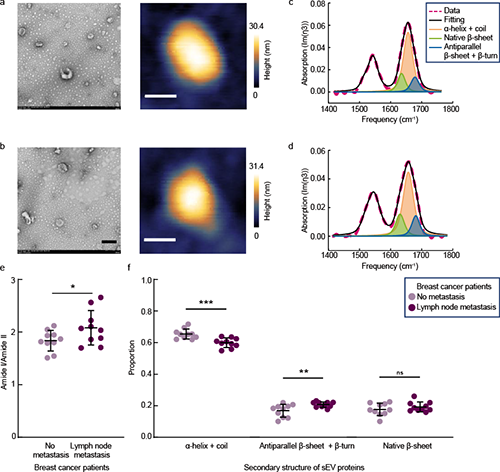
图 4组织来源细胞外分泌囊泡的蛋白指纹光谱区分无转移和淋巴结转移的乳腺癌患者。