蛋白质分子机器在生命活动中起着至关重要的作用,其行使功能过程中结构是高度动态的。传统的结构解析方法对于解决动态结构有一定的局限性,单分子方法能够以高时空分辨率实时追踪受热涨落影响的生物大分子的动力学过程。
中国科学院物理研究所/北京凝聚态物理国家研究中心软物质物理实验室SM4组多年来致力于发展单分子技术研究生物大分子结构及其动力学,在分子马达(EMBO J. 2008, 27, 3279,Nucleic Acids Res. 2015, 43, 3736,Nucleic Acids Res. 2016, 44, 4330; Phys. Rev. Lett. 2017, 119, 138102; Nature 2019, 567, 409; Nucleic Acids Res. 2020, 48, 3156; iScience 2022, 25, 103606)运行机理研究方面取得了系列成果。这些研究的主线是通过高精度的单分子测量获取生物大分子的精细动力学信息。他们发展了DNA纳米张力器 (nanotensioner, Phys. Rev. Lett. 2017),能够分辨解旋酶0.5个碱基对的步长,足以清楚地研究核酸酶的动力学过程以及结构与功能的关联。进一步应用高空间分辨率的DNA纳米张力器等技术,他们与合作者研究了单体解旋酶(RecQ, Pif1)和六元环解旋酶(T7 gp4)每消耗一个ATP分子对应的步长、步长受力的调控、步长的随机性以及在DNA损伤修复中的重要作用(Phys. Rev. Lett. 2017, 119, 138102; J. Phys. Chem. B 2018, 22, 5790; Nucleic Acids Res. 2020, 48, 3156)。在另一项工作中,他们与合作者研究了BLM解旋酶的HH亚基,发现该亚基与单链DNA发生动态相互作用而具有多种动态构象;在对相关位点突变后,他们发现这些相互作用可以调控复合物的构象并改变其解旋模式,说明了该亚基在决定BLM功能方面的重要性以及引起Bloom综合征的可能的分子机理(iScience 2022, 25, 103606)。
近日,他们与合作者运用单分子荧光共振能量转移、单分子磁镊技术及分子动力学模拟,阐明了Pif1解旋酶的两个RecA-like亚基与DNA的动态相互作用。RecA-like亚基具有序列保守性和ATP结合位点,对于Pif1活性具有重要意义。但这两个亚基与DNA结合的结构信息缺失,无法解释Pif1家族内不同解旋酶的细微但重要的差别。DNA纳米张力器在这里得到了进一步的应用。他们发现,除了晶体结构中与Pif1牢固结合的5-7个核苷酸以外,邻近的核苷酸动态性地结合在Pif1的表面,直接影响Pif1结合和解旋DNA的过程。进一步,这部分核苷酸结合在酶表面时,其构象是弯曲且动态的,因此拉力和盐屏蔽效应可以调控Pif1的功能。
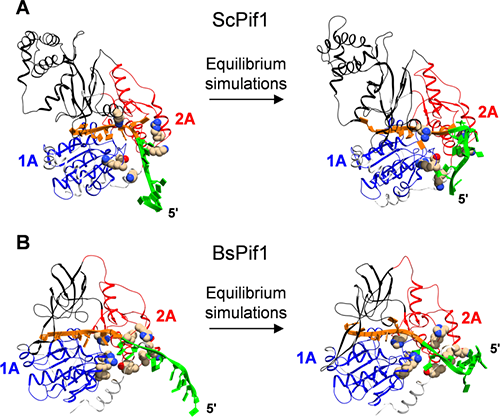
图1 分子动力学模拟揭示了Pif1对ssDNA的结合构象
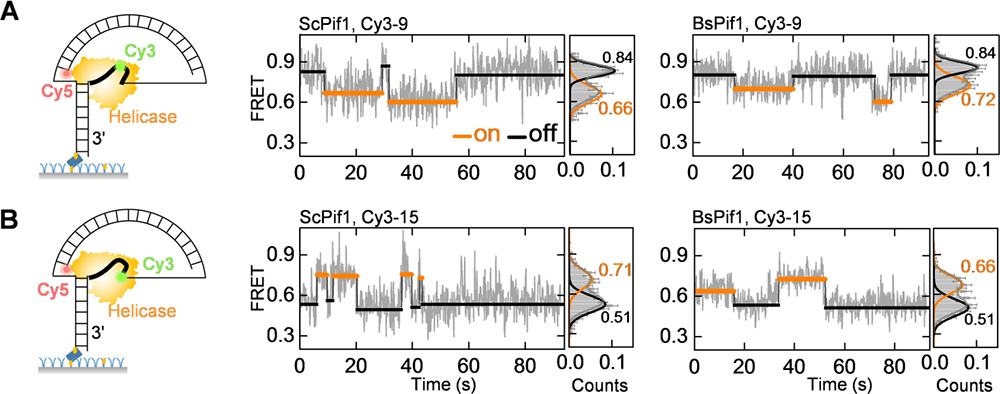
图2 DNA纳米张力器增强的smFRET揭示了DNA与Pif1结合时的动态弯曲构象
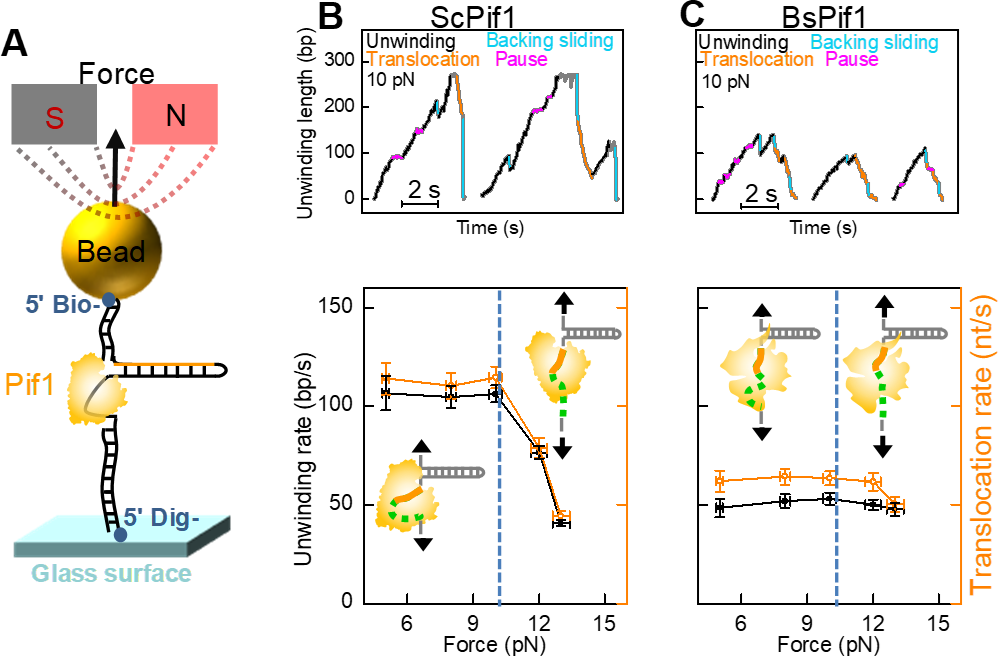
图3 单分子磁镊揭示了力调节下的Pif1解旋和行走功能
该工作以“Identification of flexible Pif1–DNA interactions and their impacts on enzymatic activities”为题,发表于著名生物学期刊Nucleic Acids Research(IF=19.16,2022),中国科学院物理研究所软物质物理实验室陆颖研究员、北京计算科学研究中心刘海广研究员为本文的共同通讯作者,物理所科研助理李菁华、博士后马建兵、北京计算科学研究中心博士后Vikash Kumar为共同第一作者。
此工作得到了国家自然科学基金(12090051,11834018,91753104,U1930402,12090050,12022409)、中国科学院先导B项目(XDB37000000)、国家重点研发项目(2019YFA0709304)、中国科学院前沿科学重点研究计划(ZDBS-LY-SLH015)、以及中国科学院青年创新促进会基金 (Y2021003)的支持。
文章链接:https://doi.org/10.1093/nar/gkac529